4. Medikamentöse Therapie
4.1 Grundprinzipien der Analgetikatherapie
Vor Beginn der Pharmakotherapie ist – wie oben beschrieben – eine genaue Bestimmung und Charakterisierung des Schmerzgeschehens erforderlich. So orientiert sich der Einsatz von Nicht-Opioid-Analgetika, Ko-Analgetika und Opioiden nicht nur an der Schmerzstärke wie in der für Tumorpatienten entwickelten klassischen WHO-Stufenempfehlung, sondern vielmehr auch am Pathomechanismus des Schmerzes [1, 2, 6]:
Nozizeptive Schmerzen sollten primär mit nicht-opioiden Analgetika und erst im zweiten Schritt mit Opioiden plus Begleitmedikation behandelt werden. Dies gilt auch für radikulär bedingte Rückenschmerzen oder Kompressionssyndrome [4, 7].
Bei Patienten mit neuropathischen Schmerzen empfehlen aktuelle Leitlinien die Gabe von trizyklischen Antidepressiva, bzw. von ionenkanalstabilisierenden Arzneimitteln wie Gabapentin [6, 8].
Anzustreben ist bei nicht-tumorbedingten chronischen Schmerzen eine regelmäßige Einnahme nach einem festen Zeitschema entsprechend der Wirkdauer der Präparate, um eine möglichst kontinuierliche Linderung bei persistierenden nozizeptiven Schmerzen zu erreichen und um der Entwicklung einer Übererregbarkeit des nozizeptiven Systems entgegenzuwirken. Jeder medikamentös behandelte Patient benötigt eine individuelle Dosierung in Abhängigkeit von Wirkung, Nebenwirkungen, Pharmakokinetik und Interaktionsprofil. Die Schmerztherapie sollte so kurz wie möglich sein. Darüber hinaus ist nach der Dosisfindung eine retardierte Dauermedikation anzustreben. Eine Bedarfsmedikation mit opioidhaltigen Analgetika in der Langzeittherapie sollte nicht durchgeführt werden [2]. Retardzubereitungen dürfen nicht durch Teilung, Zerreibung oder Zerkauen der Arzneiform zerstört werden, da dies zu einer schnelleren Wirkstofffreisetzung mit ggf. schweren unerwünschten Wirkungen führen kann.
Die orale Applikation ist in jedem Fall zu bevorzugen, da sie den Patienten am wenigsten in seinen üblichen Lebensgewohnheiten einschränkt. Die parenterale Therapie in Form von Pflastern, sublingualen oder subkutanen Applikationen ist in der Regel nur dann indiziert, wenn Symptome wie Dysphagie, Erbrechen, Bewusstseinsstörung eine orale Applikation ausschließen. Die i.v.- oder i.m.-Gabe von NSAR oder Metamizol ist nebenwirkungsreich und obsolet.
Stets müssen die Absetzkriterien für die Arzneimittel überprüft werden. Man geht davon aus, dass nach spätestens vier bis sechs Wochen bei fehlendem Erfolg kein weiteres Ansprechen auf die Therapie zu erwarten ist und die Medikation geändert werden muss [1, 2].
4.2 Wirkstoffgruppen
4.2.1 Nicht-Opioid-Analgetika
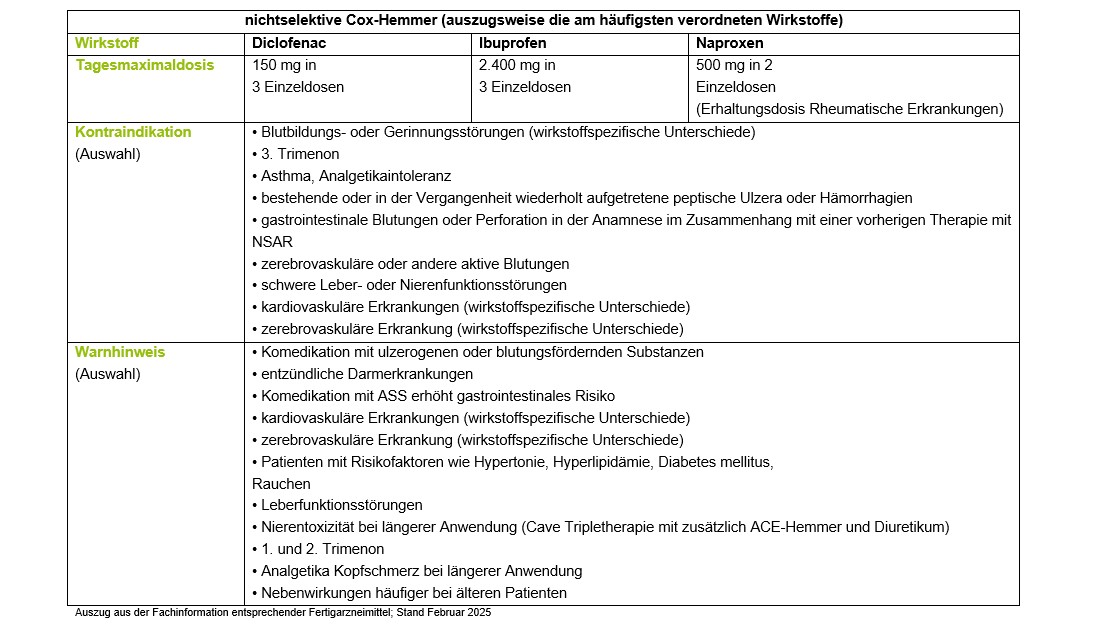
Laut einer Metaanalyse im Auftrag des Medical Research Council aus dem Jahr 2013 verdoppelten alle NSAR das Risiko für eine klinisch manifeste Herzinsuffizienz. Es zeigte sich zudem, dass das kardiovaskuläre Risiko unter Diclofenac und den Coxiben signifikant erhöht ist, unter Ibuprofen erst in der Hochdosierung ab 2.400 mg/Tag gering und unter Naproxen nicht erhöht ist [9].
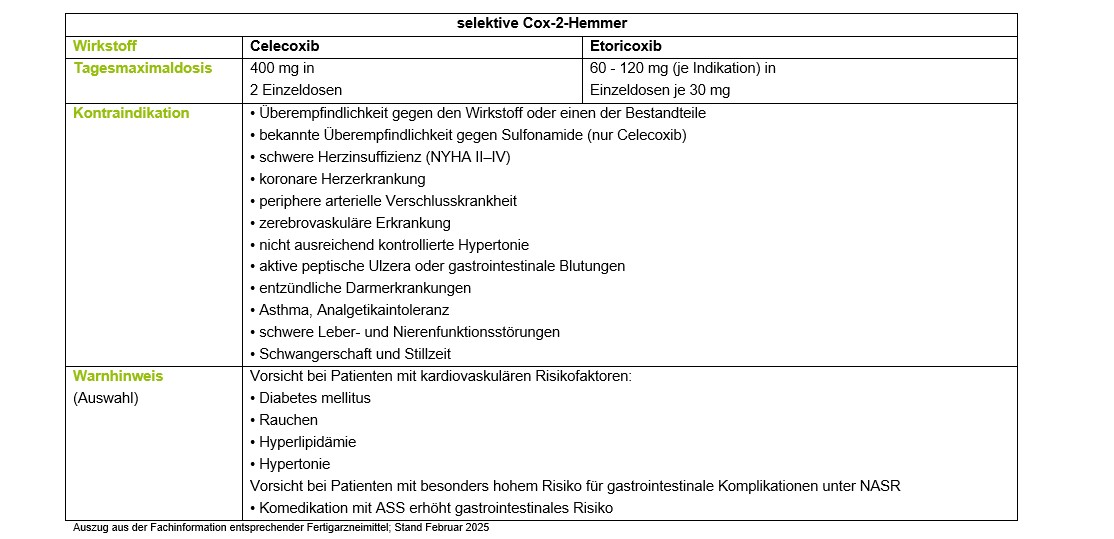
Nach einer neueren von der FDA geforderten PRECISION-Studie (publ. 2016) zur kardiovaskulären Sicherheit von Celecoxib ist der Cox-2-Hemmer den klassischen NSAR Naproxen und Ibuprofen bei Patienten mit Arthrose und erhöhtem kardiovaskulären Risiko nicht unterlegen [10]. Laut Arznei Telegramm sei die Aussagekraft der Studie jedoch durch erhebliche methodische Mängel eingeschränkt, in erster Linie, weil keine äquipotenten Dosierungen von Celecoxib gegenüber Naproxen und Ibuprofen untersucht worden seien [11].
Laut Fachinformation Coxibe-haltiger Fertigarzneimittel sollen diese bei Patienten über 65 Jahren daher nur bei strenger Indikationsstellung und mit besonderer Vorsicht wegen der im Alter allgemein erhöhten kardiovaskulären Risiken angewendet werden. Coxibe sind bei allen kardiovaskulären Risikopatienten (koronare Herzkrankheit, Schlaganfall, schwere Hypertonie, periphere arterielle Durchblutungsstörungen) auf Grund des pharmakologischen Risikopotenzials und der zahlreichen klinischen Risikodaten kontraindiziert.
Zudem ist die Anwendung von Coxiben zeitlich zu begrenzen. Die in Studien analysierten Behandlungszeiträume lagen bei diesen Wirkstoffen intermittierend bei maximal 3 bis 6 Monaten. Die Gabe von COX-2-Hemmern wird nur dann empfohlen, wenn andere NSAR kontraindiziert sind oder trotz Magenschutz nicht vertragen werden [1, 4]. Die Anwendung von Coxiben vor oder unmittelbar nach chirurgischen Eingriffen sollte unterbleiben. Selektive Cox-2-Hemmer sind aufgrund des Fehlens relevanter Vorteile und bei einem vergleichbaren Risikoprofil Mittel der zweiten Wahl.
Alle NSAR erhöhen das Risiko von gastrointestinalen Komplikationen, am geringsten fällt diese Erhöhung unter Coxiben und Diclofenac aus, am höchsten unter Ibuprofen und Naproxen [6]. Die parallele Gabe eines Protonenpumpenhemmers zu NSAR sollte prophylaktisch nur bei folgend aufgelisteten Patienten mit erhöhtem gastrointestinalen Risiko erfolgen. Eine Prophylaxe ist nicht erforderlich, wenn nur der Risikofaktor Alter >60 Jahren und sonst kein Risikofaktor vorliegt [12].
- Bekannte Ulkus-Krankheit (H.p.-Infektion)
- Gastrointestinale Blutungen oder Erkrankungen (z.B. Colitis Ulcerosa oder Morbus Crohn)
- Komedikation mit Kortikoiden, Antikoagulantien, Acetylsalicylsäure oder Antidepressiva vom SSRI-Typ
- Alkoholabusus und -abhängigkeit
- Schwere Komorbidität, z.B. rheumatoide Arthritis
Bei etwa 1-5 % der Patienten führen NSAR zu Nierenfunktionsstörungen und Blutdruckerhöhung. Davon betroffen sind Patienten mit Nierenerkrankungen, Herzschwäche, Leberzirrhose sowie ältere Menschen mit eingeschränkter Nierenfunktion.
Deshalb sind engmaschige Kontrollen der Nierenfunktion bei Patienten mit einem besonders hohen Risiko für Störungen der Nierenfunktion unter NSAR -Therapie durchzuführen. Risikofaktoren sind hier
- Über 65 Jahre
- Vorbestehende Nierenerkrankung
- Arterielle Hypertonie, Herzinsuffizienz
- Komedikation mit Diuretikum, ACE-Hemmer / Sartane
- Flüssigkeitsdefizit
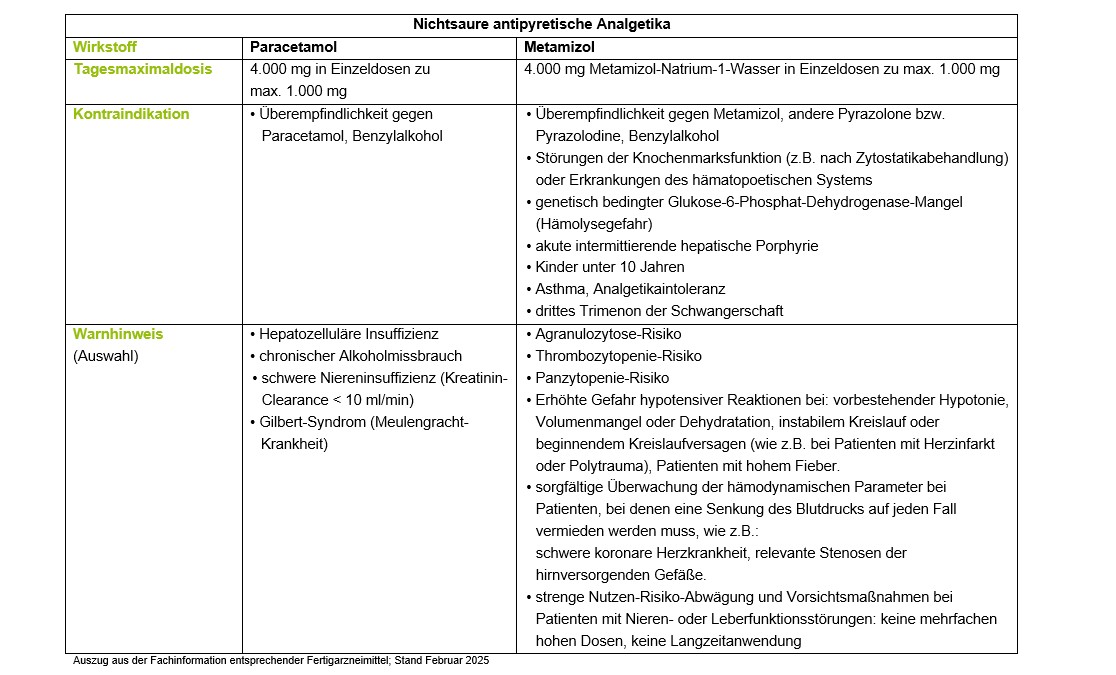
Paracetamol kann bei der Behandlung von leichten bis mittelstarken Schmerzen bei degenerativen Gelenkerkrankungen unter Beachtung von Kontraindikationen, Anwendungsbeschränkungen und Tageshöchstdosen initial eingesetzt werden.
Die Wirksamkeit in der Behandlung des akuten Kreuzschmerzes gilt als fraglich [4, 7]. Paracetamol sollte nicht zur Behandlung nicht-spezifischer Kreuzschmerzen angewendet werden. In einer 2015 veröffentlichten Übersichtsarbeit zur Effektivität und Sicherheit von Paracetamol bei Kreuzschmerzen wurden zwei neue qualitativ hochwertige RCT (insgesamt 1.962 Patienten) betrachtet. Es konnte durch die Einnahme von Paracetamol keine Verbesserung der Schmerzsymptomatik (WMD 1,4 (95% KI -1,3; 4,1)) oder der Funktionsfähigkeit (WMD -1,9 (95% KI -4,8; 1,0)) bei Patienten mit akuten oder chronischen nicht-spezifischen Kreuzschmerzen verglichen mit Placebo nachgewiesen werden [4]. Insbesondere bei Lebererkrankungen, Alkoholismus, Unterernährung besteht das Risiko einer Paracetamol-Intoxikation. Ein erhöhtes gastrointestinales Risiko besteht bei Komedikation mit einem NSAR. Bei Monotherapie sind kardiovaskuläre Nebenwirkungen wie Blutdruckerhöhung und Herzinfarkte zu berücksichtigen.
Die EMA (PRAC) hat Ende Oktober 2024 beschlossen, dass die Produktinformationen aller paracetamolhaltiger Arzneimittel (Einzelwirkstoff und Fixdosiskombinationen) geändert werden sollen, um zusätzliche Klarheit über das Risiko einer metabolischen Azidose mit vergrößerter Anionenlücke (HAGMA) aufgrund einer Pyroglutaminsäure-Azidose zu schaffen.
Fälle von HAGMA aufgrund von Pyroglutaminsäure-(5-Oxoprolin-)Azidose wurden bei Patienten mit schweren Erkrankungen, wie schwerer Nierenfunktionsstörung und Sepsis, oder bei Patienten mit Mangelernährung oder anderen Ursachen für Glutathionmangel (z.B. chronischer Alkoholismus) berichtet, die mit einer therapeutischen Dosis von Paracetamol über einen längeren Zeitraum oder mit einer Kombination von Paracetamol und Flucloxacillin behandelt wurden [13].
Bei einer Therapie mit ASS zur Thrombozytenhemmung ist zu beachten, dass Ibuprofen, Metamizol oder hochdosiertes Naproxen nach derzeitigem Kenntnisstand für eine mittel- bis langfristige Therapie als ungeeignete Analgetika anzusehen sind. Paracetamol ist in dieser Hinsicht unproblematisch [14]. Bei Notwendigkeit einer NSAR-Therapie sollte nicht-hochdosiertes Naproxen erwogen werden, dieses scheint kein relevantes Interaktionspotential mit ASS zur Thrombozytenhemmung zu haben [15].
Metamizol hat auch in oraler Form eine enge Zulassung für Kinder und Erwachsene. Es ist zugelassen zur Behandlung akuter starker Schmerzen nach Verletzungen oder Operationen, Koliken, Tumorschmerzen, sowie sonstiger akuter oder chronischer starker Schmerzen, soweit andere therapeutische Maßnahmen nicht indiziert sind.
Metamizol weist seit mehr als zehn Jahren kontinuierliche Zunahmen der Verordnung auf und ist auch 2023, diesem langjährigen Trend folgend, wieder häufiger verordnet worden. Das Agranulozytoserisiko wird derzeit auf 1:1.500 geschätzt, in der Fachinformation des Herstellers wird die Häufigkeit der Agranulozytose mit weniger als 1:10.000 angegeben. Eine aktuelle Auswertung von Spontanberichten der europäischen EudraVigilance-Datenbank für die Zeit von 1985 bis 2017 hat 1.448 Metamizolassoziierte Agranulozytosen ergeben, von denen 16,2% tödlich verliefen [3, 16].
Um das Bewusstsein für das bekannte Risiko für Agranulozytose zu schärfen und ihre frühzeitige Erkennung und Diagnose zu erleichtern, wurden die Hersteller Metamizol-haltiger Arzneimittel von den Behörden dazu angehalten, die bestehenden Warnhinweise in der Produktinformation zur metamizolinduzierten Agranulozytose entsprechend dem aktuellen Kenntnisstand zu aktualisieren (Stufenplanverfahren der EMA – Abschluss 05.12.2024). In Deutschland informiert ein Rote-Hand-Brief zu metamizolhaltigen Arzneimitteln vom 09.12.2024 daraufhin über wichtige Maßnahmen zur Minimierung der schwerwiegenden Folgen des bekannten Risikos für Agranulozytose. Patienten, die mit metamizolhaltigen Arzneimitteln behandelt werden, müssen über Frühsymptome, die auf Agranulozytose hinweisen, wie Fieber, Schüttelfrost, Halsschmerzen und schmerzhafte Schleimhautveränderungen, insbesondere im Mund, in der Nase und im Rachen oder im Genital- oder Analbereich, informiert werden. Patienten müssen die Behandlung abbrechen und sofort einen Arzt aufsuchen, wenn sie diese Symptome während der Behandlung und auch kurz nach Behandlungsende entwickeln [17].
Ein weiteres Risiko ist die im Rahmen eines anaphylaktischen Geschehens auftretende Hypotonie. Beide schweren Hauptrisiken treten zwar insbesondere nach parenteraler Applikation auf, dennoch muss prinzipiell bei jeder Darreichungsform damit gerechnet werden.
Somit ist der Stellenwert des Arzneimittels nicht in der Erstlinientherapie von chronischen Nicht-Tumorschmerzen zu sehen.
4.2.1.3 Lokal wirksame Agentien
Topisches Diclofenac Topische nichtsteroidale Antirheumatika werden mittlerweile in mehreren Leitlinien zur Therapie schmerzhafter Arthrosebeschwerden empfohlen und können eine Therapieoption vor Beginn einer oralen Schmerztherapie darstellen. Metaanalysen zeigen, dass topisch applizierte nicht-steroidale Antirheumatika (NSAR) analgetisch und funktionsverbessernd wirksam sind (Evidenz-Level sehr gering bis moderat). Die topische Applikation wurde mit weniger häufig auftretenden unerwünschten Wirkungen in Verbindung gebracht (weniger gastrointestinale, kardiovaskuläre und zentralnervöse NW, statistisch nicht signifikant) [18, 19, 20].
Für Erwachsene erfolgte eine Verordnung der verschreibungsfreien Arzneimittel auf Privatrezept zu Lasten der Versicherten (Siehe unter 6. Verordnungsfähigkeit).
Capsaicin-Creme ist verschreibungsfrei erhältlich. Einzig das kostenintensive 8% konzentrierte Capsaicin-Pflaster ist verschreibungspflichtig und damit zulasten der GKV verordnungsfähig. Dieses ist zugelassen zur Behandlung von peripheren neuropathischen Schmerzen bei Erwachsenen.
In der S2k Leitlinie Diagnose und nicht interventionelle Therapie neuropathischer Schmerzen wird der Stellenwert von topisch appliziertem Capsaicin 8% primär in der Behandlung von lokalisierten neuropathischen Schmerzen gesehen. Ansonsten gilt das Capsaicin-Pflaster beim neuropathischen Schmerz nicht als Mittel der 1. Wahl. Es ist dann eine Therapieoption, wenn First-Line-Arzneimittel wie Nicht-Opioidanalgetika, Antidepressiva, Calciumkanalblocker/Antiepileptika nicht wirksam oder kontraindiziert sind [6, 8].
Ebenso verhält es sich bei Patienten mit postherpetischer Neuralgie für den Einsatz von Lidocain-Pflastern [8]. Der Einsatz von Lidocain-Pflastern bei neuropathischen Schmerzen anderer Ursache ist nicht von der Zulassung gedeckt und entspricht einem Off-Label-Use. Krankenkassen stellen regelmäßig Einzelfallprüfanträge, bei denen der Einsatz von Versatis mutmaßlich im Off-Label-Use erfolgt ist [2].
4.2.2 Opioide
Opioide sind erst nach Ausschöpfen aller anderen therapeutischen Möglichkeiten indiziert.
Eine Opioid-Therapie soll insbesondere dann unter Zuziehung eines ausgewiesenen Experten für Schmerztherapie und ggf. eines Suchtspezialisten begonnen bzw. durchgeführt werden, wenn der Patient eine besonders hohe Tagesdosis benötigt, wenn Fehlgebrauchs- und Missbrauchsverhalten bekannt ist oder wenn der Patient Zeichen einer Abhängigkeitserkrankung aufweist.
4.2.2.1 Schwach wirksame Opioide
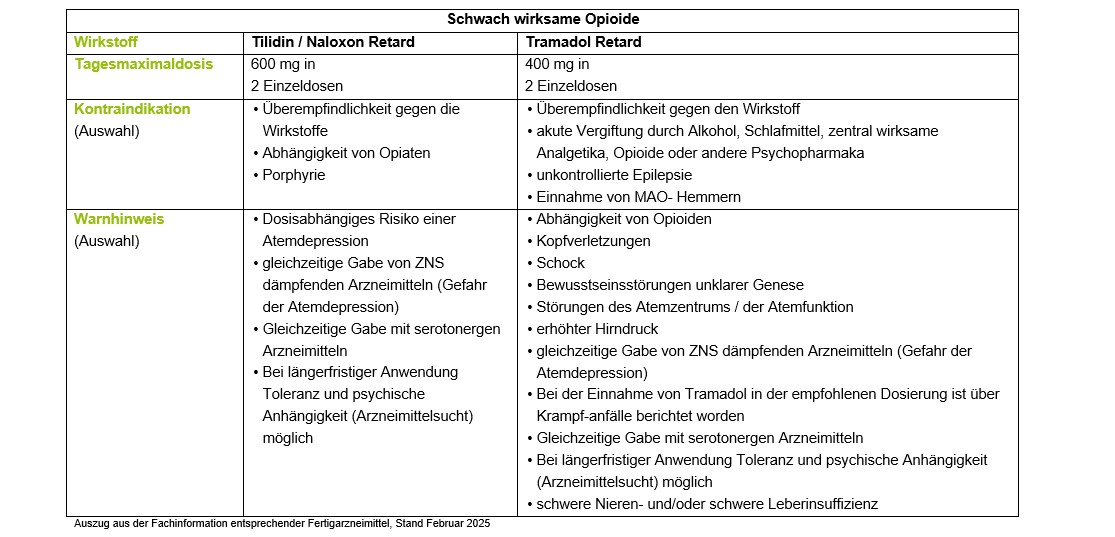
Wenn nicht-opioide Arzneimittel unzureichend wirken, kann zur Behandlung starker Schmerzen die kurzfristige Gabe von Opioiden eine therapeutische Alternative sein. Nach dem WHO-Stufenschema können in zweiter Stufe schwach wirksame Opioide als Monotherapie bzw. in Kombination mit Nicht-Opioiden eingesetzt werden.
Die Differenzierung zwischen Opioiden der Stufe II und III beruht nicht auf pharmakologischen Unterschieden. Alle Opioid-Analgetika binden an Rezeptoren im zentralen und peripheren Nervensystem. Sie haben eine vergleichbare Wirkungsweise, unterscheiden sich jedoch in der Intensität ihrer schmerzstillenden Effekte und im Nebenwirkungsprofil.
Eine Kombination aus Opioiden der Stufe II und III führt aufgrund der Rezeptorkonkurrenz der Wirkstoffe zu keinem additiven Effekt und ist daher zu vermeiden.
Tilidin ist ein Prodrug und wird erst im Körper in seine aktive Form überführt. Es besteht die Möglichkeit eines genetisch bedingt reduzierten Umwandlungsprozesses, so dass bei diesen Patienten die analgetische Wirksamkeit reduziert ist. Auch bei Patienten mit schwerer Leberinsuffizienz ist mit einer verminderten Wirkung zu rechnen, da die Umwandlung zum eigentlichen Wirkstoff Nortilidin nicht ausreichend erfolgt. Bei Niereninsuffizienz ist keine Dosisanpassung notwendig.
Tilidin besitzt in hohen Dosen einen ausgeprägten euphorisierenden Effekt. Insbesondere flüssige, nicht-retardierte Tilidinpräparate, die im Gegensatz zu Retardpräparaten (Tabletten) der Betäubungsmittel Verschreibungsverordnung unterliegen, können wegen des schnelleren Anflutens der Wirkstoffkonzentration zu einem erhöhten Abhängigkeitsrisiko führen [21].
Tramadol beeinflusst neben den analgetisch wirksamen Opiatrezeptoren auch deszendierende noradrenerge und serotonerge schmerzhemmende Bahnen.
Eine Kombination von Tramadol und Antidepressiva sollte wegen des zusätzlichen
5-Hydroxytryptamin-Wiederaufnahmehemmer-Mechanismus von Tramadol (Gefahr Serotoninsyndrom) nicht erfolgen. Tramadol fällt nicht unter das BtMG. Tramadol hat nur eine kurze Wirkdauer von 2-3 Stunden. Für die Behandlung chronischer Schmerzen ist deshalb die retardierte Form zu verwenden.
Bei schwerer Einschränkung der Nieren- und Leberfunktion soll Tramadol nicht angewendet werden.
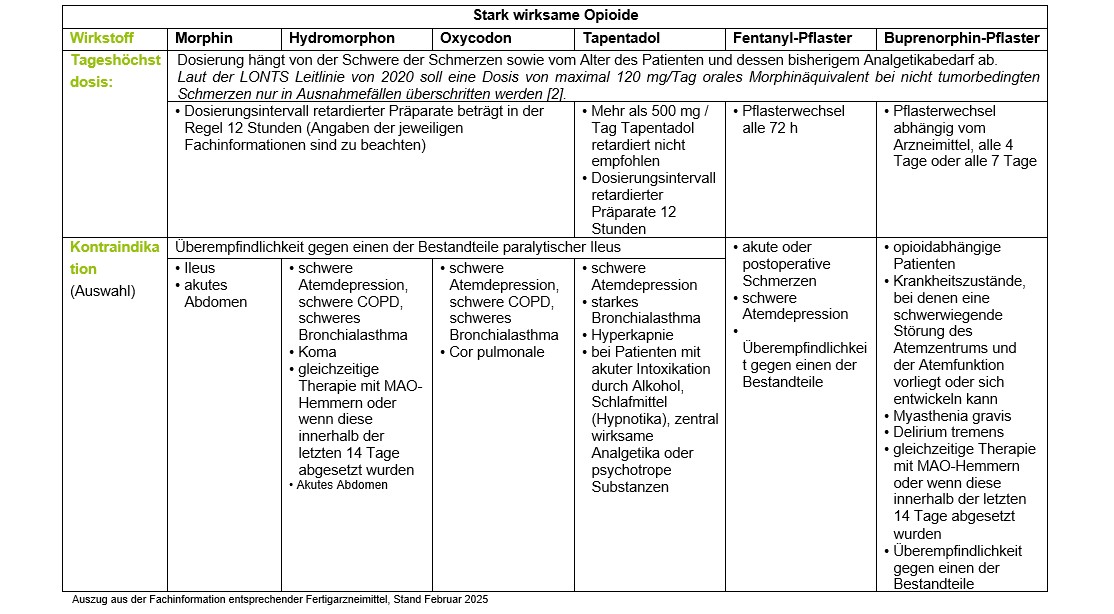
4.2.2.2 Stark wirksame Opioide
Beim nicht-tumorbedingten Schmerz ist die Indikation zur Behandlung mit stark wirksamen Opioiden streng zu stellen. Stark wirksame Opioide sollten nur bei sehr schweren therapierefraktären Schmerzen eingesetzt werden. Die Gabe sollte kurzfristig erfolgen. Tritt die gewünschte Schmerzlinderung/Funktionsverbesserung nicht ein, sollte die Opioidtherapie beendet werden [1].
Ist eine Therapie mit stark wirksamen Opioiden unumgänglich, ist wie bereits angeführt, auf eine möglichst orale Applikation retardierter Präparate nach einem festen Zeitschema zu achten. So werden transdermale Opioide explizit nicht für den Einsatz beim akuten oder subakuten nicht-spezifischen Kreuzschmerz empfohlen [4].
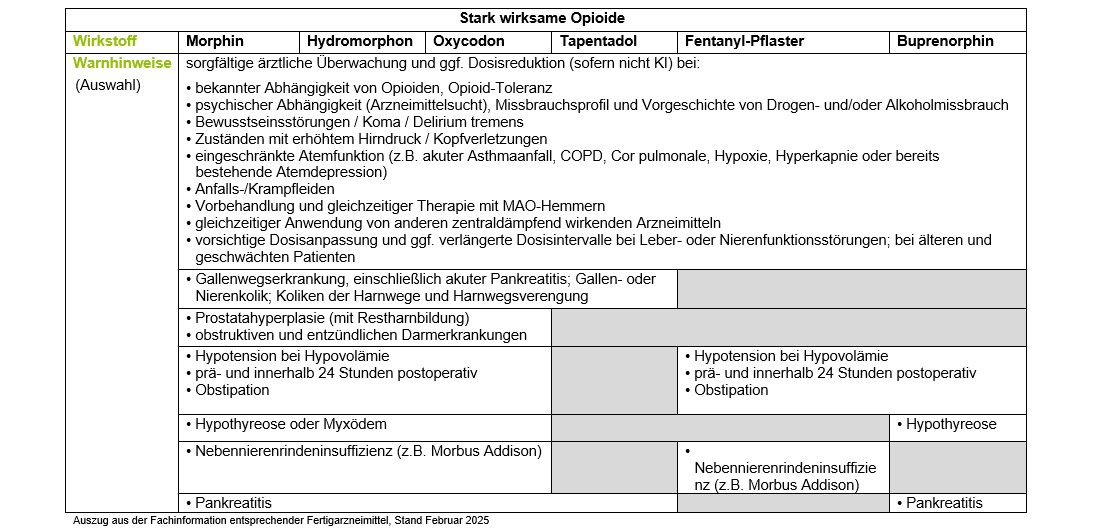
Die Therapie mit stark wirksamen Opioiden bedarf vor dem Hintergrund der zu erwartenden Nebenwirkungen wie z.B. Obstipation, Sedierung, Übelkeit oder Euphorie der engmaschigen Kontrolle und ggf. Anpassung. Insbesondere die Kontrolle der Leber- und Nierenfunktion im Verlauf ist zwingend erforderlich.
Eine Dosis von maximal 120 mg/Tag orales Morphinäquivalent soll bei nicht tumorbedingten Schmerzen nur in Ausnahmefällen überschritten werden [2].
Opioide können auch zu einer paradoxen Schmerzverstärkung (Opioid-induzierte Hyperalgesie) führen, ohne dass der aktuelle Krankheitsprozess zunimmt. Hierbei zeigt sich oft ein Wechsel der Schmerzlokalisation hin zu einem wenig eindeutigen, diffusen Ganzkörperschmerz. Eine Erhöhung der Opioiddosis bleibt ohne Effekt. Als beste Prophylaxe gilt eine individuelle, am Schmerzmechanismus orientierte analgetische Kombinationstherapie, bei der immer die niedrigste mögliche, effektive Opioiddosis angestrebt werden sollte [2].
Mittel der ersten Wahl für chronische Schmerzen ist orales, retardiertes Morphin [3, 22].
Morphin wird bereits in Darm und Leber extensiv metabolisiert. Ein Metabolit (Morphin-6-Glucoronid) ist analgetisch wirksam. Die glucuronidierten Metabolite werden hauptsächlich über die Niere ausgeschieden. Somit ist im Fall einer Niereninsuffizienz mit einer Akkumulation der Morphinmetaboliten zu rechnen.
Hydromorphon ist stärker wirksam als Morphin. Hydromorphon ist bei Patienten mit Niereninsuffizienz dem Morphin vorzuziehen, da es zu keiner Akkumulation toxischer Metabolite kommt.
Oxycodon ist potenter als Morphin. Oxycodon wird im Darm und in der Leber zu teilweise aktiven Metaboliten metabolisiert, die über die Niere ausgeschieden werden. Bei Patienten mit eingeschränkter Nierenfunktion oder Leberfunktion ist eine Dosis und Intervallanpassung erforderlich.
Die fixe Kombination von Oxycodon mit Naloxon in einem Präparat zeigt keine klinisch relevante Überlegenheit gegenüber einer Therapie mit einem Opioidmonopräparat plus zusätzlichem Laxans. Auch unter der fixen Kombination von Oxycodon mit Naloxon war ein hoher Anteil von Patienten laxantienpflichtig [3, 23]. Der Zusatz von Naloxon führt durch seinen Opiatantagonismus dagegen eher zu den Symptomen des Opiatentzuges mit Schwitzen, Diarrhoe, Übelkeit, usw. [24].
Die zugelassene Maximaldosis für die fixe Kombination von Oxycodon und Naloxon ist auf 160 mg Oxycodon und 80 mg Naloxon beschränkt. Dies ist von Nachteil, wenn eine höhere Dosis Oxycodon (Tagesmaximaldosis: 400 mg) zur Schmerztherapie benötigt wird.
Die Kassenärztliche Bundesvereinigung und die AkdÄ empfehlen die fixe Kombination Oxycodon/Naloxon nicht für die Behandlung starker Schmerzen [25].
In den Studien zu Oxycodon / Naloxon erfolgte ein Vergleich mit Oxycodon, jedoch kein Vergleich mit Oxycodon und einem konventionellen Laxans oder anderen Opioiden [1].
Es ist derzeit nicht eindeutig belegt, ob peripher wirkende Opioid-Rezeptor-Antagonist (PAMORA) klinisch gegenüber den etablierten (wenngleich in dieser Anwendung kaum evidenzgestützten) und kostengünstigeren Laxantien in der Behandlung der Opioid induzierten Obstipation Vorteile bieten (bei deutlich höheren Kosten). Eine abschließende Bewertung des Stellenwertes im Vergleich zu konventionellen Laxantien ist daher derzeit nicht möglich [2, 26]. Ein Therapieversuch mit den kostenintensiven PAMORA sollte daher allenfalls bei therapieresistenter Obstipation (unter Standardtherapie) mit schwerwiegender klinischer Ausprägung erwogen werden.
Tapentadol ist ein zentral wirksames Analgetikum, welches sowohl als Agonist am µ-Opioid-Rezeptor als auch als Noradrenalin-Wiederaufnahmehemmer wirkt. Tapentadol gilt ebenfalls als Betäubungsmittel. In der analgetischen Potenz ist es schwächer als Morphin. Bei Patienten mit stark eingeschränkter Leber- und Nierenfunktion wird der Einsatz nicht empfohlen.
Ein Vorteil von Tapentadol gegenüber einem reinen Opioid ist nicht belegt, insbesondere nicht gegenüber Standardtherapeutika wie Morphin. Die AkdÄ und KBV ordnen das Arzneimittel als Reservetherapeutikum ein [27].
Fentanyl ist ein reiner µ-Rezeptoragonist und wirkstärker als Morphin. Es wird bei chronischen Schmerzen als Pflaster eingesetzt. Fentanyl wird hauptsächlich über die Leber (Cytochrom–P450-3A4) metabolisiert und als inaktive Substanz über die Niere ausgeschieden. Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich, dagegen bei Patienten mit schwerer Leberinsuffizienz. Durch den Abbau über CYP3A4 ist ein hohes Potential für Interaktionen mit anderen Pharmaka gegeben, die das Enzym hemmen.
Vor Anwendung eines Fentanylpflasters sollte geprüft werden, ob ein oral zu verabreichendes Opioid oder gar eine andere analgetische Therapie indiziert ist. Die Wirkung tritt bei der Anwendung eines Fentanylpflasters erst mit einer Latenz von 12 bis 24 Stunden ein, daher ist die Verabreichung bei akuten Schmerzen nicht sinnvoll.
Fieber und Hitze erhöhen die Hautpermeabilität und können bei Anwendung von transdermalen Systemen zu einem raschen Anstieg der Wirkstoffe im Blut führen. Im deutschen Spontanmeldesystem liegen Berichte zu Überdosierungen durch Fentanylpflaster mit zum Teil schwerwiegenden Folgen, wie z.B. Bewusstseinsstörungen, Somnolenz oder Atemdepression, vor [28] Patienten mit Intoxikationen sollten mindestens 24 Stunden überwacht werden, da nach Abziehen des Pflasters noch mehrere Stunden Wirkstoff aus einem Wirkstoffdepot in den oberen Hautschichten freigesetzt wird.
Buprenorphin weist in der transdermalen und sublingualen Form eine sehr viel höhere Potenz als peroral verabreichtes Morphin auf. Als Pflaster liegt die Wirkdauer bei 72 bis 96 h, bei einer HWZ von 30 h nach Pflasterentfernung. Bei eingeschränkter Nierenfunktion ist eine Dosisanpassung auch bei höherer Dosierung nicht erforderlich, dagegen aber bei schweren Leberfunktionsstörungen.
4.2.3 Neuropathische Schmerzen
Bei Patienten mit neuropathischen Schmerzen empfiehlt die „S2k Leitlinie Diagnose und nicht interventionelle Therapie neuropathischer Schmerzen“ von 2019 den initialen Einsatz von trizyklischen Antidepressiva bzw. ionenkanalstabilisierenden Arzneimitteln wie Gabapentin. Wenn diese nicht ausreichend wirken, stehen in letzter Stufe Opioide zur Verfügung, wobei die Wirksamkeit von Opioiden bei neuropathischen Schmerzen als sehr gering zu bewerten ist [8].
Nicht-Opioidanalgetika (NSAR, Cox-2-Inhibitoren, Paracetamol, Metamizol) sollten dagegen nicht zur Therapie chronischer neuropathischer Schmerzen verwendet werden, da es keine Evidenz zur Wirksamkeit gibt [8].
4.2.3.1 Antidepressiva
Trizyklische Antidepressiva Mehrere Metaanalysen und eine Cochrane-Analyse bekräftigen die Wirksamkeit von trizyklischen Antidepressiva bei neuropathischem Schmerz, heben aber hervor, dass die Evidenz auf mehreren kleinen Studien beruht und deshalb nur von moderater Qualität ist und der Behandlungseffekt bisher wohl eher überschätzt wurde [4]. Amitriptylin wird in den aktuellen Leitlinien als Mittel der 1. Wahl zur Linderung neuropathischer Schmerzen genannt [8]. Es zeigte in einem systematischen Review als Zusatz zu Schmerztherapien wegen diabetischer Neuropathie, postherpetischer Neuralgie, Schmerzen nach Schlaganfall und Fibromyalgie im Vergleich zu Placebo einen Benefit. Positive Wirkungen werden auch bei Schmerzen nach Rückenmarksverletzungen beschrieben, sofern sie mit einer depressiven Verstimmung assoziiert sind.
Zugelassen ist Amitriptylin zur langfristigen Schmerzbehandlung im Rahmen eines therapeutischen Gesamtkonzeptes in dem empfohlenen Dosisbereich von 25-75 mg täglich am Abend.
Bei Patienten mit nicht-spezifischem Kreuzschmerz zeigte ein 2008 veröffentlichter Cochrane Review von RCT, dass die Anwendung von Antidepressiva im Hinblick auf Schmerzlinderung und Besserung der Funktionsfähigkeit nicht effektiver war als Placebo. Vor diesem Hintergrund wird der Einsatz von trizyklischen Antidepressiva beim Kreuzschmerz nicht empfohlen bzw. nur als Mittel der fernen Wahl bewertet bei Vorliegen von indikationsrelevanten Komorbiditäten (Depression) [4, 6].
Ohne Effekte werten die Leitlinien den Einsatz von Trizyklika auf die HIV-assoziierte Neuropathie. Aufgrund der bestehenden Nebenwirkungen (Mundtrockenheit, Tremor, Sehstörungen) wird auf die Notwendigkeit hingewiesen, mit der geringst möglichen Trizyklika-Dosis zu behandeln.
Antidepressiva vom SSNRI-Typ (z.B. Duloxetin) sollten bei Personen mit nicht-spezifischem Kreuzschmerz nicht regelhaft und nur bei indikationsrelevanter Komorbidität (schwere Depression, Angststörung) eingesetzt werden [4, 6].
Duloxetin besitzt in einer Dosierung von 60 bis maximal 120 mg pro Tag die Zulassung zur Behandlung von Schmerzen bei diabetischer Polyneuropathie. Der Einsatz bei neuropathischen Schmerzen anderer Ursache entspricht einem Off-Label-Use [8].
Venlafaxin, welches im Off-Label-Use bei neuropathischen Schmerzen eingesetzt wird, ist – laut G-BA – in dieser Indikation nicht zulasten der GKV verordnungsfähig, da die Wirksamkeitsbelege für Venlafaxin in der sehr heterogenen Indikation „neuropathischer Schmerz“ unzureichend sind. Bei verfügbaren, zugelassenen therapeutischen Alternativen ist der Off-Label-Einsatz von Venlafaxin in dieser Indikation nicht gerechtfertigt [29].
4.2.3.2 Antikonvulsiva
Bei Patienten mit diabetischer Neuropathie wirkte in Studien Gabapentin ab einer Tagesdosis von 1.200 mg geringfügig besser als Placebo und ähnlich stark wie Amitriptylin. Gabapentin ist damit eine Alternative zur Therapie neuropathischer Schmerzen, bietet aber keine Vorteile gegenüber Amitriptylin [1, 30]. Erst ab einer Tagesdosis von mindestens 1.200 mg konnte eine Überlegenheit im Vergleich zu Placebo hinsichtlich des Kriteriums einer mindestens 30%igen Schmerzreduktion erreicht werden [6]. Die Zieldosis muss langsam eintitriert werden.
Unerwünschte zentralnervöse Nebenwirkungen sind relativ häufig mit Schwindel (21%), Schläfrigkeit (16 %), peripheren Ödemen (8 %), Gangstörungen (9 %). Im Juni 2017 weist die europäische Arzneimittelbehörde EMA auf das Risiko für Atemdepression ohne gleichzeitige Anwendung von Opioiden hin. Wie für Pregabalin existiert für Gabapentin ein Risiko für Missbrauch, insbesondere bei Patienten mit Abhängigkeit oder Missbrauch anderer Substanzen [31]. Das Missbrauchsrisiko von Gabapentin scheint geringer als das von Pregabalin zu sein [32].
In der nationalen Versorgungs-Leitlinie Nicht-spezifischer Kreuzschmerz werden Antiepileptika bei nicht-spezifischem Kreuzschmerz als nicht-indiziert beurteilt [7].
Pregabalin ist in Tagesdosen über 150 mg (300 mg bis 600 mg) für die Therapie von peripheren und zentralen neuropathischen Schmerzen zugelassen.
Andere Substanzgruppen (z.B. trizyklische Antidepressiva wie Amitriptylin) sind gleich wirksam. In einer neueren Metaanalyse zeigt Pregabalin eine deutlich höhere NNT (number needed to treat) als trizyklische Antidepressiva [3, 33].
Auch unter Pregabalin treten häufig (15 bis 50 %) Schwindel und Schläfrigkeit auf, es werden kognitive und koordinative Störungen berichtet. Es besteht das Risiko eines erheblichen Abhängigkeitspotenzials sowie von Entzugserscheinungen nach dem Absetzen [8]. Pregabalin sollte daher nur nach eingehender Untersuchung und klarer Indikationsstellung verordnet werden. Insbesondere bei Einnahme- oder Verordnungsmengen über der zugelassenen Höchstgrenze (600 mg/Tag) ist an eine Abhängigkeitsentwicklung zu denken und eine Abdosierung schnellst möglich einzuleiten [31, 34]. Bei Dosierungen von Pregabalin über der zugelassenen Höchstdosis werden regelhaft Prüfanträge im Einzelfall durch die Krankenkassen gestellt.
In der S2k Leitlinie neuropathische Schmerzen 2019 werden Gabapentinoide als ein Mittel der ersten Wahl neben Trizyklika empfohlen, jedoch ist die Therapie mit deutlich höheren Kosten verbunden, und das Abhängigkeitspotential ist zu beachten [8].
Carbamazepin kann für neuropathische Schmerzen aufgrund der geringen Evidenz und der häufigen Nebenwirkungen nicht generell empfohlen werden, kann jedoch im Einzelfall erwogen werden [8]. Ein zulassungskonformer Einsatz ist nur bei den folgenden Krankheitsbildern möglich: Trigeminus-Neuralgie, genuine Glossopharyngeus-Neuralgie und schmerzhafte diabetische Neuropathie.
4.2.3.3 Cannabis
Die Wirksamkeit von Cannabis zur Behandlung von chronischen neuropathischen Schmerzen wird von verschiedenen Fachgesellschaften unterschiedlich bewertet und reicht von gering bis moderat.
Aus der „S2k Leitlinie „Diagnose und nicht interventionelle Therapie neuropathischer Schmerzen“ aus 2019 geht hervor, dass Cannabinoide zur Therapie neuropathischer Schmerzen jeglicher Ursache nicht empfohlen werden können, da ihr Effekt eher gering ausgeprägt ist und die Nebenwirkungsrate hoch ist. Nur in Einzelfällen kann bei Ausschöpfung etablierter Therapien der Einsatz von Cannabinoiden im Rahmen eines multimodalen Schmerztherapiekonzepts erwogen werden.
Das Positionspapier der European Pain Federation 2018 empfiehlt Cannabis in der Behandlung chronischer neuropathischer Schmerzen hingegen als Drittlinientherapie aufgrund einer mäßigen Qualität der Evidenz für eine moderate Schmerzreduktion. Für alle übrigen chronischen Schmerzsyndrome liegen Hinweise auf eine unzureichende Wirksamkeit vor.
Bis einschließlich des Jahres 2023 haben sich an der publizierten Evidenzlage keine grundsätzlichen Änderungen ergeben.
Zu den häufigsten Nebenwirkungen von Cannabis-Arzneimitteln gehören Müdigkeit und Konzentrationsstörungen. Weitere Nebenwirkungen sind Stimmungsänderungen (Euphorie, Dysphorie), Schwindel, Mundtrockenheit, reduzierter Tränenfluss, Muskelrelaxation, Steigerung des Appetits, Tachykardie, orthostatische Hypotension und kardiale Ischämie, in Einzelfällen bis zum Myokardinfarkt.
Es gibt keine Belege dafür, dass verschiedene Formulierungen von medizinischem Cannabis, wie etwa., Dronabinol oder Cannabisextrakt, wirksamer oder sicherer sind als getrocknetes medizinisches Cannabis (Cannabisblüten). Fertigarzneimittel (Sativex, Canemes) sind nicht zur Behandlung von neuropathischen Schmerzen zugelassen. Es ist zu beachten, dass nach Erkenntnissen der BfArM-Begleiterhebung in der Versorgungspraxis oft vergleichsweise hohe Dosen von Cannabisblüten pro Tag verordnet werden, mit entsprechend hohen Tageskosten. Daher soll bei indiziertem Einsatz zunächst eine Therapie mit anderen Darreichungsformen erfolgen, z.B. Dronabinol-Tropfen. Die Verordnung von Cannabis in Form von getrockneten Blüten ist zu begründen (AM-RL § 44-45).
In Anbetracht der unsicheren Evidenzlage zur Wirksamkeit, der hohen Nebenwirkungsrate und des hohen Missbrauchsrisikos bei zudem hohen Therapiekosten können medizinische Cannabispräparate in der Behandlung chronischer neuropathischer Schmerzen allenfalls als Reserveoption nach Ausschöpfung etablierter Therapieoptionen angesehen werden.
Die Zweckmäßigkeit einer Cannabis-Therapie ist im Therapieverlauf durchgehend zu kontrollieren und zu reevaluieren. Insbesondere sollte hierbei auch die Verordnungsmenge an Cannabis berücksichtigt werden – gerade bei vom Patienten angegebener nicht ausreichender Wirksamkeit einer in der Regel als zweckmäßig zu bewertenden Dosierung / Verordnungsmenge ist das Therapiekonzept im Gesamten zu hinterfragen. An dieser Stelle wird nochmals auf das hohe Missbrauchsrisiko von Cannabispräparaten verwiesen. Die Krankenkassen stellen regelmäßig Einzelfallprüfanträge bei unplausibel hoch erscheinenden Verordnungsmengen an Cannabispräparaten [35-39]. In der aktuell gültigen Arzneimittel-Zielvereinbarung 2025 der Vertragspartner in Baden-Württemberg wurden Höchstquoten für Cannabisblüten definiert. Die Beachtung und Einhaltung dieser unterstützt eine wirtschaftliche Verordnungsweise.
[https://www.kvbawue.de/praxis/verordnungen/arzneimittel/zielvereinbarungen]
Verordnungsvoraussetzungen
Versicherte mit einer schwerwiegenden Erkrankung haben Anspruch auf die Versorgung mit Cannabis in Form von getrockneten Blüten oder Extrakten (THC-Gehalt mindestens 0,2 %) und auf Versorgung mit Arzneimitteln mit den Wirkstoffen Dronabinol oder Nabilon, wenn
- eine allgemein anerkannte, dem medizinischen Standard entsprechende Leistung nicht zur Verfügung steht oder
- wenn diese im Einzelfall nach der begründeten Einschätzung des behandelnden Vertragsarztes unter Abwägung der zu erwartenden Nebenwirkungen und unter Berücksichtigung des Krankheitszustandes des Versicherten nicht mehr zur Anwendung kommen kann.
- Zudem muss eine nicht ganz entfernt liegende Aussicht auf eine spürbare positive Einwirkung auf den Krankheitsverlauf oder auf schwerwiegende Symptome bestehen [40].
Genehmigung vor Erstverordnung – ja oder nein?
Cannabis darf von jeder Facharztgruppe verordnet werden; die Arzneimittel-Richtlinie (AM-RL) sieht keine Einschränkung des Verordnerkreises vor. Grundsätzlich besteht ein Genehmigungsvorbehalt, dieser gilt jedoch nicht für alle Arztgruppen [41]:
1. Facharzt- und Schwerpunktbezeichnungen
- Allgemeinmedizin
- Anästhesiologie
- Frauenheilkunde und Geburtshilfe mit Schwerpunkt Gynäkologische Onkologie
- Innere Medizin
- Innere Medizin und Angiologie
- Innere Medizin und Endokrinologie und Diabetologie
- Innere Medizin und Gastroenterologie
- Innere Medizin und Hämatologie und Onkologie
- Innere Medizin und Infektiologie
- Innere Medizin und Kardiologie
- Innere Medizin und Nephrologie
- Innere Medizin und Pneumologie
- Innere Medizin und Rheumatologie
- Neurologie
- Physikalische und Rehabilitative Medizin
- Psychiatrie und Psychotherapie
2. Andere Fachgruppen mit folgenden Zusatzbezeichnungen
- Geriatrie
- Medikamentöse Tumortherapie
- Palliativmedizin
- Schlafmedizin
- Spezielle Schmerztherapie
Cannabis nicht mehr als BtM klassifiziert
Seit 1. April 2024 erfolgt die Verordnung von Cannabis zu medizinischen Zwecken per Muster 16 oder eRezept.
Lediglich das vollsynthetische Cannabinoid Nabilon (Fertigarzneimittel Canemes - zugelassen für die Behandlung von chemotherapiebedingter Emesis und Nausea bei Krebspatienten) ist weiterhin in der Anlage III BtMG gelistet. Somit bleibt der BtM-Status auch nach dem 1. April 2024 bestehen. Die Verordnung von Canemes erfolgt weiterhin mit dem BtM-Rezept.
4.2.3.4 Myotonolytika
Laut der aktuellen Leitlinie nicht-spezifischer Kreuzschmerz sollten Muskelrelaxanzien nicht zur Behandlung akuter und chronischer nicht-spezifischer Kreuzschmerzen angewendet werden. Aufgrund der bekannten Nebenwirkungen wie allergischen Reaktionen, Sedierung, Beeinträchtigung der Fahrtauglichkeit, Gefahr der Abhängigkeit und der bekannten Hepatotoxizität einzelner Arzneimittel dieser Gruppe wird von der Anwendung bei nicht-spezifischen Kreuzschmerzen abgeraten. Allenfalls bei unzureichender Besserung der akuten Kreuzschmerzsymptomatik durch andere empfohlene medikamentöse und nicht-medikamentöse Maßnahmen ist gegebenenfalls eine zeitlich befristete (nicht länger als zwei Wochen fortlaufende) Verschreibung in Betracht zu ziehen [4].
Tolperison wurde auf Empfehlung der EMA in seiner Anwendungsbreite eingeschränkt und soll auch in Deutschland nur noch zur Behandlung von Spastizität nach Schlaganfall bei Erwachsenen eingesetzt werden. Die Indikation Muskelverspannungen bei Erkrankungen der Wirbelsäule und achsennahen Gelenken wurde aufgrund unklarer Nutzen/Risikorelation fallengelassen, da auch bei diesem Arzneimittel in der breiten Anwendung schwere Hautreaktionen bis hin zu anaphylaktischen Schockzuständen bei Überempfindlichkeitsreaktionen beobachtet wurden [42].
Zuletzt wurde in einem Rote-Hand-Brief vom 02.06.2020 nochmals davor gewarnt, Tolperison in den widerrufenen Indikationen wie Erkrankungen des Bewegungsapparates muskuloskelettalen Ursprungs zu verordnen [43].
Die Datenlage zu Orphenadrin, Methocarbamol und Pridinol ist, insbesondere was methodisch hochwertige, kontrollierte, randomisierte Studien anbetrifft, problematisch, so dass hier im Einzelfall eine unklare Nutzen/Risikorelation vorliegt.