3. Therapieoptionen
Die eingehende Aufklärung von Patientinnen und Patienten über eine notwendige Therapie, eine gemeinsame Entscheidungsfindung und die Bereitschaft der Betroffenen selbständig und aktiv zu einer gesunden Lebensweise (Bewegung, Ernährung, Nikotinverzicht) beizutragen sind für eine rationale und auch wirtschaftliche Osteoporosetherapie essentiell.
3.1 Basistherapie
Ernährungsmedizinisch wird eine tägliche Calciumaufnahme im Erwachsenenalter von 800 – 1.500 mg Calcium empfohlen. Bei Patientinnen und Patienten ohne eine spezifische medikamentöse Therapie soll die Ernährung mindestens 1.000 mg Calcium täglich enthalten. Calcium-Supplemente sollten eingenommen werden, wenn die Menge von 1.000 mg Calcium/Tag durch die Ernährung nicht sicher erreicht werden kann. Bei Patientinnen und Patienten mit einer spezifischen medikamentösen Therapie, insbesondere bei der Anwendung von Antiresorptiva, soll die Versorgung mit 1.000 mg Calcium zur Vermeidung einer Hypokalzämie bei ausreichender Einnahme von Vitamin D sichergestellt werden. Darauf soll besonders bei der Anwendung parenteraler Antiresorptiva und dem Osteoanabolikum Romosozumab geachtet werden. Eine alleinige medikamentöse Calciumsupplementierung ohne eine gleichzeitige Vitamin-D-Therapie ist nicht sinnvoll. Unverzichtbar ist in der Regel eine Vitamin-D-Supplementation mit 25- Hydoxy- Vitamin D, aber nicht mit einem aktiven Vitamin-D-Metaboliten.
Die Vitamin D-Supplementierung soll, bei einer generell empfohlenen Tagesdosis von 800 IE Cholecalciferol, 2.000-4.000 IE Cholecalciferol nicht überschreiten. Bolusgaben sollen die Höhe der maximalen Einzeldosis 20000 I.E. nicht überschreiten.
Die Messung von 25-OH-Vitamin-D-Spiegeln als Massenuntersuchung ist nicht zweckmäßig. Sie kann aber in Ausnahmefällen bei schwerwiegendem klinischem Verdacht auf eine Vitamin-D-Stoffwechselstörung sinnvoll sein. Hinweise zur Verordnungsfähigkeit der Präparate erhalten Sie unter Kapitel 7.
3.2 Spezifische medikamentöse Therapie
Die Auswahl eines geeigneten Arzneimittels sollte anhand der individuellen Patientenkonstellation (Risikoprofil, Kontraindikationen, Begleiterkrankungen, Unverträglichkeiten) und der Kosten getroffen werden. Vom Wirkmechanismus wird unterschieden zwischen vorwiegend antiresorptiven (Bisphosphonate, Denosumab, Raloxifen, Östrogene) und osteoanabolen (anbaustimulierenden) Wirkstoffen (z.B. Teriparatid, Abaloparatid, Romosozumab).
3.2.1 Bisphosphonate
Bisphosphonate gelten auf Grund von Wirksamkeit und Sicherheit sowie der Evidenz aus klinischen Studien und Kostengründen bei moderatem Risiko als Mittel der ersten Wahl.
Wichtig sind:
- die Einhaltung einer strikt regelmäßigen Einnahme unter Beachtung des Einnahmemodus (nüchtern, 30 bis 60 Minuten vor dem Frühstück mit einem großen Glas Wasser in aufrechter Position),
- die Vermeidung einer gleichzeitigen Einnahme von Calciumpräparaten (cave: Komplexbildung zwischen Calcium und Bisphosphonat)
Ein intravenöses Bisphosphonat ist gerechtfertigt bei:
- zeitlich eindeutig assoziierbaren gastrointestinalen Unverträglichkeitsreaktionen unter oraler Bisphosphonat-Therapie
- Bettlägerigkeit
- Malassimilation (zum Beispiel M. Crohn, Colitis ulcerosa, Pankreasinsuffizienz)
Vorhofflimmern ist keine Kontraindikation für Bisphosphonate, ebenso wenig wie eine kürzliche Fraktur, eine endoprothetische oder erfolgte zahnärztliche Versorgung. Zahnärztliche Eingriffe, die den Kieferknochen betreffen (Zahnextraktionen, Wurzelspitzenresektionen, parodontalchirurgische Maßnahmen, Wurzelkanalbehandlung), sollten zuerst durchgeführt werden und abheilen, bevor wenige Wochen später mit der Bisphosphonat-Therapie begonnen wird. Eine Basistherapie kann sofort initiiert werden.
Geringfügige zahnärztliche Beschwerden, die nur eine Behandlung der Zähne erfordern (Kariesbehandlung, Zahnreinigung), können jederzeit durchgeführt werden, unabhängig von jeder Osteoporosebehandlung. Operative Kiefereingriffe unter oder nach einer antiresorptiven Therapie sollen nach sorgfältiger Prüfung der Indikation unter Einhaltung empfohlener Infektions- und Wundheilungskautelen erfolgen.
Treten unter konsequenter Behandlung mit einem Bisphosphonat oder einem anderen Antiosteoporotikum einschließlich Basistherapie osteoporoseassoziierte Knochenbrüche auf, kann nach Überprüfung eventuell vorliegender (medikamentösbedingter) Sturzrisiken ein Substanzwechsel zweckmäßig sein.
Der Einsatz einer Therapie mit Teriparatid ist dann insbesondere bei der Glukokortikoid-induzierten Osteoporose und bei Männern mit erheblicher Osteoporose zu prüfen.
Nur bei Frauen mit Osteoporose und einem besonders hohen Frakturrisiko z.B. bei Auftreten von zwei osteoporotischen Frakturen ohne adäquates Trauma innerhalb eines Jahres und ohne das Vorliegen kardio- und zerebrovaskulärer Vorschäden (koronare Herzerkrankung, Myokardinfarkt, Apoplex) kann auch der Einsatz des seit März 2020 zugelassenen Romosozumab für die Dauer eines Jahres erwogen werden.
3.2.2 Denosumab
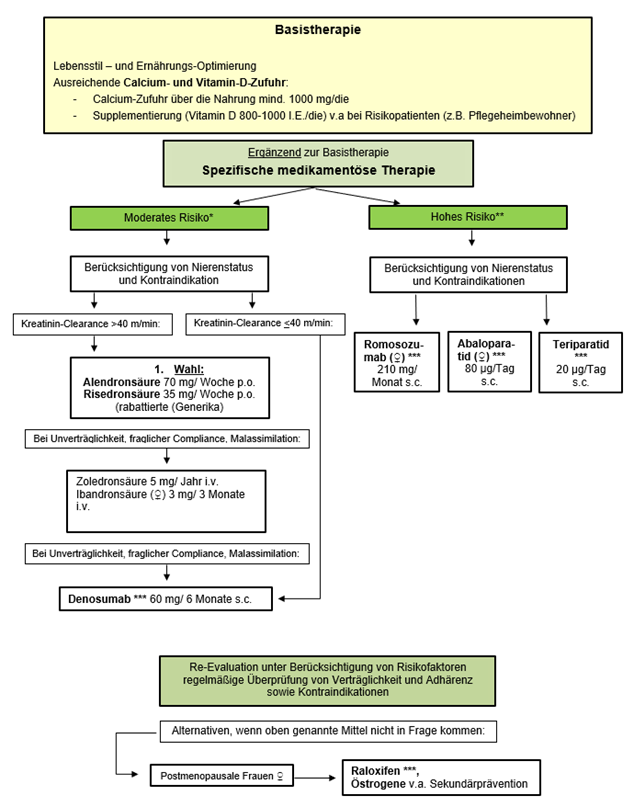
Denosumab (Prolia® 60mg Fertigspritze alle 6 Monate) kann bei Männern und Frauen mit Osteoporose bei einer Kreatinin-Clearance ≤ 40 ml / min oder bei Bisphosphonat-Unverträglichkeit als Alternative verordnet werden (siehe Abb. 1). Es ist kein Mittel der ersten Wahl.
Die Datenlage hinsichtlich direkter Vergleiche von Denosumab vs. Bisphosphonaten ist limitiert. Laut einem IQWiG- Vorbericht vom 25.05.2022 können belastbare Aussagen nur zum Vergleich von Denosumab gegenüber Zolendronat getroffen werden.
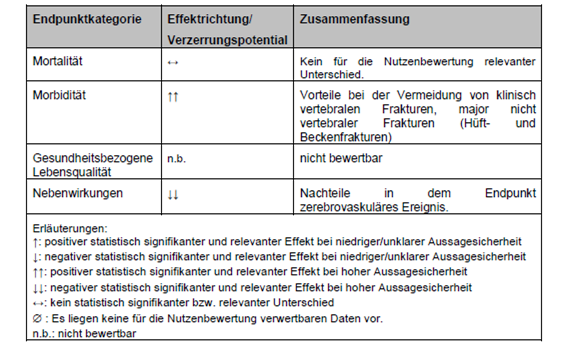
- Kein Anhaltspunkt für einen höheren Nutzen oder Schaden ergab sich aus den vorliegenden Daten für die Endpunkte Gesamtmortalität, Frakturen im Bereich der Hüfte, distale Radiusfrakturen, symptomatische Wirbelkörperfrakturen, nicht vertebrale symptomatische Frakturen, SUEs, Abbruch wegen UEs sowie UEs und SUEs des Gastrointestinaltrakts.
- Für die Endpunkte Schmerzen, Funktionseinschränkung, gesundheitsbezogene Lebensqualität, Osteonekrosen des Kiefers und symptomatische atypische Femurfrakturen lagen keine für den Vergleich von Denosumab gegenüber Bisphosphonaten verwertbaren Daten vor, sodass sich auch hier jeweils kein Anhaltspunkt für einen höheren Nutzen oder Schaden ergab.
- In der Gesamtabwägung von Nutzen und Schaden ergab sich endpunktübergreifend kein Anhaltspunkt für einen höheren oder geringeren Nutzen bzw. Schaden einer Behandlung mit Denosumab im Vergleich zu Zoledronat.
Zugelassene Anwendungsgebiete sind
- die Behandlung der Osteoporose bei postmenopausalen Frauen und bei Männern mit erhöhtem Frakturrisiko
- die Behandlung von Knochenschwund im Zusammenhang mit Hormonablation bei Männern mit Prostatakarzinom mit erhöhtem Frakturrisiko sowie
- die Behandlung von Knochenschwund im Zusammenhang mit systemischer Glukokortikoid- Langzeittherapie bei erwachsenen Patienten mit erhöhtem Frakturrisiko
Denosumab reduzierte bei postmenopausalen Frauen das Risiko für osteoporotische Frakturen im Vergleich zu Placebo signifikant.
Bei Männern mit Osteoporose und erhöhtem Frakturrisiko erhöhte Denosumab im Vergleich zu Placebo nach einem Jahr die Knochenmineraldichte an allen gemessenen Skelettlokalisationen signifikant. Die Wirksamkeit bezüglich Frakturen bei mit Denosumab behandelten Männern wurde nicht evaluiert.
Bei Männern mit nicht- metastasiertem Prostatakarzinom unter hormonablativer Therapie reduzierte Denosumab nach drei Jahren im Vergleich zu Placebo das Risiko für neue vertebrale Frakturen signifikant. Die ARR (absolute Risikoreduktion) betrug 2,4%.
Die Wirksamkeit und Sicherheit der Anwendung von Denosumab bei Frauen und Männern mit einer glukokortikoidinduzierten Osteoporose (GIO) wurde gegenüber der oralen Verabreichung von Risedronat untersucht. Primärer Endpunkt war die Auswirkung auf die Knochendichte (bone mineral density, BMD) der Lendenwirbel. Dabei zeigte sich sowohl nach einem wie auch nach zwei Jahren unter Denosumab eine signifikante Erhöhung der BMD gegenüber Risedronat. Die Studie war nicht darauf ausgelegt einen Unterschied in der Frakturhäufigkeit zu untersuchen.
Im April 2014 sprach die EMA die Empfehlung aus, die Fachinformation um Warnhinweise zum Auftreten von Kieferosteonekrosen sowie eine Auflistung von klinischen Merkmalen einer schweren Hypokalzämie zu ergänzen. Grund hierfür waren schwere symptomatische Hypokalzämien unter Denosumab, darunter auch Fälle mit tödlichem Ausgang. Die AkdÄ empfiehlt daher, vor einer Behandlung mit Denosumab die Calciumkonzentration im Blutserum zu überprüfen und gegebenenfalls zu korrigieren. Unter der Behandlung ist auf eine ausreichende Gesamtzufuhr an Calcium und Vitamin D zu achten (1.000 mg Calcium und 1000 IE Vitamin D3 täglich). Ausnahme hiervon bildeten Patienten mit Hyperkalzämie. In jedem Falle sollten die mit Denosumab behandelten Patienten über mögliche Symptome einer Hypokalzämie, wie z.B. periorales Taubheitsgefühl, Parästhesien an den Extremitäten, Muskelkrämpfe, Erschöpfung, Übererregbarkeit, Angstzustände oder Depression, aufgeklärt werden.
Des Weiteren ist zu beachten, dass im Februar 2013 ein Rote-Hand-Brief zu Denosumab aufgrund seltener Fälle von atypischen Femurfrakturen bei Patienten mit Osteoporose veröffentlicht wurde.
Das beauflagte Schulungsmaterial für Patienten und Ärzte kann über www.Prolia-RM.de bezogen werden.
Das zweckmäßige Vorgehen nach Absetzen von Denosumab zur Vermeidung von sogenannten Anschlussfrakturen ist im Abschnitt über Raloxifen erläutert.
Wichtig: Der Einsatz von Prolia® mit verkürzten Dosierungsintervallen und/oder zur Behandlung von Tumoren des Knochens entspricht einem off-label-use und ist zudem unwirtschaftlich.
3.2.3 Teriparatid
Teriparatid (Forsteo®, Biosimilars) stellt neben Romosozumab eine osteoanabole Therapieoption für das Hoch-Risiko-Patientenkollektiv dar.
Für postmenopausale Frauen ist die Evidenz zur Wirksamkeit der ARCH-Studie mit Romosozumab überzeugender als die für Teriparatid in der VERO-Studie. In der STRUCTURE-Studie, einem direkten Vergleich von Teriparatid und Romosozumab konnte (allerdings für den Surrogatparameter Knochendichte) eine Überlegenheit von Romosozumab gezeigt werden. In der Gesamtschau der Verordnungen von Osteoporosemedikamenten spielt Teriparatid eine eher untergeordnete Rolle.
Der Wechsel auf Teriparatid (seit 2019 auch als Biosimilars verfügbar) kann sinnvoll sein, wenn trotz ein- bis zweijähriger konsequenter Pharmakotherapie einer primären Osteoporose mehrere neue Knochen- oder Wirbelbrüche aufgetreten sind. Bei manifester Glukokortikoid-induzierter Osteoporose mit mehreren Knochenbrüchen sowie bei Männern mit hohem Frakturrisiko kann der Einsatz von Teriparatid zweckmäßig sein, wobei die Therapie immer nach maximal zwei Jahren beendet und kein zweites Mal durchgeführt werden soll.
Antiosteoporotische Kombinationstherapien (z. B. Bisphosphonat plus Parathormon-Analogon) zusätzlich zur Basistherapie sind nicht zweckmäßig, da keine additiven Wirkungen auf die Senkung des Frakturrisikos belegt sind.
Bei malignen Skeletterkrankungen oder Knochenmetastasen, schwerer Niereninsuffizienz oder Kindern/Jugendlichen sind Parathormon-Präparate kontraindiziert.
Gemäß der aktuellen DVO Leitlinie von 2023 wird bei einem absoluten Frakturrisiko oberhalb der osteoanabolen Schwelle (ab 10% / 3 Jahre, DVO-Risikorechner) eine osteoanabol wirksame Substanz (derzeit zugelassen: Romosozumab, Teriparatid und Abaloparatid) empfohlen. Dies gilt unter Beachtung des Zulassungsstatus und der Kontraindikationen.
Die Behandlung mit Osteoanabolika sollte von einem in der Therapie der Osteoporose erfahrenen Facharzt eingeleitet und überwacht werden.
3.2.4 Romosozumab
Romosozumab (Evenity®) ist seit März 2020 nach Teriparatid der zweite verfügbare osteoanabole Wirkstoff zur Behandlung der postmenopausalen manifesten Osteoporose bei deutlich erhöhtem Frakturrisiko. Diese Therapieoption sollte Hoch- Risiko- Patientinnen vorbehalten sein. Eine alleinige Unverträglichkeit von Bisphosphonaten oder Denosumab ist keine Indikation für den Einsatz von Romosozumab. Eine sorgfältige Nutzen- Risiko- Analyse und eine Aufklärung der Patientinnen ist gerade bei Arzneimitteln mit neuen Wirkmechanismen unabdingbar.
In die für die Zulassung maßgebliche ARCH-Studie wurden 4093 postmenopausale Frauen im Alter von 55-90 Jahren eingeschlossen und entweder mit Romosozumab (12 Monate), gefolgt von Alendronsäure (mindestens 12 Monate) oder mit Alendronsäure allein (mindestens 24 Monate) behandelt.
Einschlusskriterien:
- T- Score = 2,0 an der Gesamthüfte oder Oberschenkelhals und entweder mindestens zwei moderate oder schwere vertebrale Frakturen oder eine Fraktur des proximalen Oberschenkels innerhalb der letzten zwei Jahre
- T- Score = 2,5 an Gesamthüfte oder Oberschenkelhals und entweder mindestens eine moderate oder schwere vertebrale Fraktur oder mindestens zwei milde vertebrale Frakturen
Romosozumab, gefolgt von Alendronsäure zeigte im Vergleich zu Alendronsäure einen deutlichen Vorteil in der Vermeidung von Frakturen, einem essenziellen Therapieziel der Osteoporosetherapie.
Romosozumab vs. Alendronsäure (Absolutes Risiko):
- Neue vertebrale Frakturen 4,1% vs. 8,0%
- Klinische Frakturen 9,7% vs. 13,0 %
- Nicht vertebrale Frakturen 8,7% vs. 10,6%
- Hüftfrakturen 2,0% vs. 3,2%
Hieraus ergibt sich eine NNT von 26 für die Vermeidung von klinischen Wirbelkörperfrakturen und von 83 für die Vermeidung von Schenkelhalsfrakturen.
Bezüglich Abbruch wegen unerwünschter Ereignisse, Kieferosteonekrose, gastrointestinalen Erkrankungen sowie Gesamtmortalität zeigte sich zwischen den beiden Behandlungsgruppen kein statistisch signifikanter Unterschied.
Die osteoanabole Wirkung von Romosozumab hält nur einige Monate an, wobei überraschenderweise durch Hemmung der Osteoklastenreifung auch eine antiresorptive Wirkung eintritt, was insgesamt in einem verminderten Knochenumbau (low turnover) resultiert [ ].
Für die Einzelkomponente zerebrovaskuläres Ereignis zeigte sich in der Arch- Studie ein statistisch signifikanter Unterschied zum Nachteil von Romosozumab, gefolgt von Alendronsäure gegenüber Alendronat allein nach der Gesamtbetrachtungsdauer von 24 Monaten. Die Effektrichtung zum Nachteil von Romosozumab zeigt sich bereits nach 12 Monaten (2,5% vs. 1,9%), allerdings ohne statistische Signifikanz. Die Mehrheit der zerebrovaskulären Ereignisse trat erst in der zweiten Studienhälfte auf [IQWiG- Addendum]. Zu berücksichtigen sind deshalb Risikofaktoren wie bekannte kardiovaskuläre Erkrankung, arterielle Hypertonie, Hyperlipidämie, Diabetes mellitus, Tabakkonsum, schwere Nierenfunktionsstörung oder Alter. [Schulungsmaterial, FI]. Romosozumab ist bei Patientinnen mit einem vorausgegangenen Schlaganfall oder Myokardinfarkt kontraindiziert. Bei Auftreten eines solchen Ereignisses während der Therapie muss die Behandlung abgebrochen werden.
Nach einer Therapie mit Romosozumab ist eine zweijährige antiresorptive Nachbehandlung mit Alendronsäure ebenfalls zweckmäßig.
Im Rahmen der Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V (sog. AMNOG- Verfahren) hat der Gemeinsame Bundesausschuss am 3. September 2020 zu Ausmaß und Wahrscheinlichkeit des Zusatznutzens von Romosozumab (Evenity®) gefolgt von Alendronsäure gegenüber Alendronat alleine bei postmenopausalen Frauen mit manifester Osteoporose und deutlich erhöhtem Frakturrisiko folgenden Beschluss gefasst: Hinweis auf einen geringen Zusatznutzen (https://www.g-ba.de/downloads/40-268-6825/2020-09-03_AM-RL-XII_Romosozumab_D-516_TrG.pdf, letzter Zugriff: 23.01.2025).
Tab. 4: Zusammenfassung der Ergebnisse relevanter klinischer Endpunkte
Für Romosozumab wurde bei der Zulassung angeordnet, dass es nur unter Verwendung von Schulungsmaterialien in Verkehr gebracht werden darf, dies zur Wissensvermittlung und Hilfe bei der sicheren Anwendung des Arzneimittels. Das behördlich beauflagte und genehmigte Schulungsmaterial zu Romosozumab beinhaltet einen Leitfaden für Ärzte sowie eine Patienteninformationskarte. (https://www.pei.de/DE/arzneimittelsicherheit/schulungsmaterial/schulungsmaterial-node.html?cms_gtp=11236256_list%253D3 letzter Zugriff: 23.01.2025)
3.2.5 Abaloparatid
Abaloparatid (Eladynos®) wurde im Dezember 2022 von der EMA zur Behandlung der Osteoporose bei postmenopausalen Frauen mit erhöhtem Frakturrisiko zugelassen und steht seit dem 15.04.2024 im Handel zur Verfügung. Wie Teriparatid gehört auch Abaloparatid zur Gruppe der Parathormone. Das Arzneimittel stimuliert über den PTH1-Rezeptor-Signalweg die Osteoblastenaktivität und erhöht so die Knochenneubildung an der trabekulären und kortikalen Knochenoberfläche.
Abaloparatid wird subkutan verabreicht (einmal täglich 80 µg). Die Behandlungsdauer sollte bei maximal 18 Monaten liegen. Danach sollte eine Weiterbehandlung erfolgen, zum Beispiel mit Bisphosphonaten.
Sehr häufige Nebenwirkungen sind Hyperkalziurie und Schwindel. Abaloparatid ist u.a. kontraindiziert bei schwangeren oder stillenden Frauen, bei Frauen im gebärfähigen Alter sowie bei Frauen mit Hyperkalzämie sowie bei schwerer Nierenfunktionsstörung, bei Patientinnen mit bekanntem Osteosarkomrisiko sowie bei Patientinnen mit malignen Erkrankungen des Skeletts oder Knochenmetastasen.
Einen besonderen Warnhinweis gibt es in der Fachinformation zum Thema »Orthostatische Hypotonie und erhöhte Herzfrequenz«. Abaloparatid kann eine gefäßerweiternde Wirkung auf die glatte Gefäßmuskulatur und positive chronotrope/inotrope Wirkungen auf den Herzmuskel haben. Eine individuelle Nutzen-Risiko-Bewertung ist daher wichtig.
Vor Beginn der Behandlung mit Abaloparatid sollten der Blutdruck, der kardiale Status und ein EKG ausgewertet werden. Patientinnen mit Herzerkrankung sind auf eine Verschlechterung ihrer Erkrankung zu überwachen. Wenn eine schwere orthostatische Hypotonie oder schwere kardiovaskuläre Symptome auftreten, ist die Behandlung abzubrechen.
Soweit beurteilbar, zeigen die vorliegenden Daten keinen Vorteil von Abaloparatid gegenüber Teriparatid hinsichtlich der Vermeidung von vertebralen oder nicht vertebralen Frakturen. Unter Abaloparatid scheinen Hyperkalzämien seltener aufzutreten als unter Teriparatid, unerwünschte kardiale Ereignisse hingegen häufiger. Die AkdÄ bewertet die Evidenz als unzureichend. Die Studie ACTIVE ist aufgrund der zu kurzen Studiendauer und ihrer methodischen Limitationen nicht als Datengrundlage für die Nutzenbewertung geeignet.
Im Verfahren zur Nutzenbewertung nach § 35a SGB V hat der G-BA mit Datum vom 02.10.2024 den Beschluss gefasst, dass ein Zusatznutzen von Abaloparatid gegenüber der Vergleichstherapie (Alendronsäure, Risedronsäure, Zoledronsäure, Denosumab, Romosozumab [Frauen mit deutlich erhöhtem Frakturrisiko] und Teriparatid) nicht belegt ist.
Begründet wurde dieser Beschluss damit, dass für postmenopausale Frauen mit Osteoporose und erhöhtem Frakturrisiko keine geeigneten Daten zur Bewertung des Zusatznutzens von Abaloparatid gegenüber der zweckmäßigen Vergleichstherapie vorlagen, da in der vom pharmazeutischen Unternehmer vorgelegten Phase-III-Studie ACTIVE nur ein Vergleich von Abaloparatid gegenüber Teriparatid erfolgte.
Bitte beachten Sie, dass die Preisverhandlungen zur Vereinbarung eines Erstattungsbetrages voraussichtlich erst zum 02.04.2025 abgeschlossen sein werden.
3.2.6 Raloxifen
Der selektive Östrogenrezeptormodulator (SERM) Raloxifen ist zugelassen zur Behandlung und Prävention der Osteoporose bei postmenopausalen Frauen. Gegenüber Placebo verminderte Raloxifen die Inzidenz von vertebralen Frakturen, nicht jedoch die extravertebraler Frakturen.
Raloxifen verursacht ein erhöhtes thromboembolisches Risiko, so dass diese Substanz bei Patienten mit stattgehabten Thrombosen, Lungenembolien, Adipositas, Faktor-V-Leiden-Mutation kontraindiziert bzw. bei Immobilität, bei Tumorerkrankungen oder immobilisierten Patienten unzweckmäßig ist.
Raloxifen kann bei Patientinnen mit gleichzeitigem Östrogenrezeptor-positiven Mammakarzinom günstig sein, kann aber Postmenopause-Beschwerden auslösen oder verstärken.
Wenn eine Entscheidung zwischen Raloxifen und anderen Therapiemöglichkeiten, einschließlich einer Östrogenbehandlung, getroffen werden soll, sind im individuellen Fall klimakterische Symptome, Auswirkungen auf das Uterus- und Brustgewebe sowie kardiovaskuläre Risiken und Nutzen zu berücksichtigen [FI Raloxifen].
Zu beachten:
Da die Wirkung der osteoanabolen Wirkstoffe Teriparatid, Romosozumab sowie die von Denosumab und Raloxifen nach wenigen Monaten abklingt, können nach Absetzen dieser Wirkstoffe sog. Reboundeffekte teils mit Anschlussfraktu-ren auftreten. Daher ist nach Beendigung der Therapie mit diesen Arzneimitteln eine zumindest ein- bis zweijährige Nachbehandlung (sog. „Versiegelungstherapie“) mit einem langwirksamen Bisphosphonat (z. B. Alendronat oder Zoledronat) angebracht.
3.2.7 Östrogene
Östrogene haben ebenfalls eine nachgewiesene frakturpräventive Wirkung. Nach heutigem Kenntnisstand erhöhen sie allerdings das Risiko für eine Reihe von Erkrankungen (z.B. Thromboembolie, Myokardinfarkt, Schlaganfall, Mamma-/Uteruskarzinom, Alzheimer-Demenz), weshalb sie derzeit nicht zur Osteoporosebehandlung eingesetzt werden, sofern nicht gravierende östrogendefizitbedingte Beschwerdebilder im Rahmen der Postmenopause vorliegen, die einen Einsatz von Östrogenen über begrenzte Zeit und in der niedrigst wirksamen Dosis rechtfertigen.
Abb. 1: Therapiealgorithmus Osteoporose
* Moderates Risiko – 3-Jahres Frakturrisiko > 5% (vgl. DVO-LL) sowie 3-Jahres-Frakturrisiko von 3% - 5% bei Patientinnen und Patienten mit irreversiblen und/oder starken Risikofaktoren oder sehr hohem Frakturrisiko für eine bevorstehende Fraktur („imminentes Frakturrisiko“)
** Hohes Risiko – 3-Jahres Frakturrisiko > 10 % (vgl. DVO-LL)
*** Nachbehandlung erforderlich z.B. mit langwirksamen Bisphosphonat